感谢 A*STAR 研究人员的努力,对抗胶质母细胞瘤等致命脑癌的斗争可能很快就会从重大突破中受益。研究小组发现癌细胞生长与其微环境之间存在新的联系。

肿瘤中的干细胞会促进某些癌症(包括脑癌)的发展和耐药性,从而阻碍抗癌治疗。它们的干性,即生长、自我更新和分化成各种癌细胞的能力,受到其微环境的影响。这解释了与其他细胞、粘附分子和细胞周围基质(也称为细胞外基质的相互作用)。
除了充当细胞的支持物之外,细胞外基质还介导细胞信号传导,并且是促进癌细胞干细胞性的重要组成部分。然而,研究主要集中在细胞内的信号通路来评估癌症干性,因此人们对微环境的作用知之甚少。
为了阐明细胞外基质对癌症干细胞的贡献,A*STAR 生物工程和纳米技术研究所的 Andrew Wan 领导的团队使用了一种涉及脑癌三维 (3D) 模型的方法。在该模型中,缠结的电纺聚苯乙烯纤维为细胞培养提供了多孔支架。这些纤维涂有特定的细胞外基质蛋白,称为层粘连蛋白。
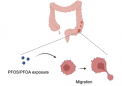
研究人员在 3D 模型和二维 (2D) 传统聚苯乙烯组织培养板中培养来自侵袭性脑肿瘤胶质母细胞瘤的细胞,并监测它们的生长(见图)。基因和蛋白质表达研究表明,3D 培养系统比 2D 培养系统更能提高癌症干性。
Wan 的团队进一步发现 3D 系统和细胞外基质共同作用来刺激干性。具体来说,他们发现了证据表明两种整合素(存在于胶质母细胞瘤细胞膜中的蛋白质)通过与层粘连蛋白相互作用促进了癌症干细胞样细胞的形成。
国家神经科学研究所的同事通过计算方法分析患者神经胶质瘤数据库,证实了这些观察结果。 “我们的合作者表明,这些相同的蛋白质通常在更具侵袭性的脑肿瘤中以更高的水平表达,”万说。
 新传媒网
新传媒网