费城儿童医院(CHOP)的研究人员已经确定了一种在骨髓恶性肿瘤的翻译后修饰和激活中起作用的分子,使其成为潜在的治疗靶点。研究结果今天发表在《临床研究杂志》上。

一组称为RAS蛋白的蛋白质控制信号通路,这些信号通路调节正常细胞生长的几个重要方面,并且在失调时调节恶性转化。沿RAS途径的蛋白质突变是癌症中最普遍的致癌驱动因素之一,因此研究人员一直有兴趣靶向这一途径来破坏癌细胞的生长。KRAS和NRAS基因的突变经常在骨髓疾病中发现(15%-60%),包括急性髓系白血病(AML)和慢性粒单核细胞白血病(CMML)。
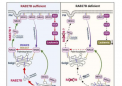
RAS蛋白仅在与细胞膜相关时才广播信号;当脂肪分子(称为脂质)被添加到RAS蛋白中时,就会发生这种情况,从而使其在细胞膜上运输。跨膜运输的周期非常快,每10到20分钟发生一次。CHOP团队决定通过确定促进这一过程的靶点来探索抑制这种膜运输的潜力。
在此过程中,研究人员发现一种名为RAB27B的酶有助于将脂质添加到NRAS中,并将NRAS转运到质膜,这是激活所必需的。通过蛋白质组学研究,研究人员发现RAB27B在CBL或JAK2突变髓系恶性肿瘤中上调,其表达与AML预后不良相关。
此外,研究人员发现RAB27B耗竭抑制了CBL缺陷或NRAS突变细胞系的生长。他们还发现,小鼠模型中的Rab27b缺乏显着降低了体内CMML的发育。重要的是,他们观察到原发性人类AML中的RAB27B耗竭抑制了致癌NRAS信号传导和白血病生长。研究人员进一步揭示了RAB27B表达与AML对MEK抑制剂的敏感性之间的显着相关性,MEK抑制剂靶向RAS途径上的突变。
 新传媒网
新传媒网